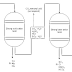Sel Elektrokimia : SEL ELEKTROLISIS (2 of 2)
On Thursday, October 01, 2015
Elektrolisis berasal dari kata Electro (listrik) dan Lisis (penguraian) yang artinya
penguraian larutan (elektrolit) karena adanya arus listrik searah. Sel Elektrolisis berbeda dengan Sel Volta dan ini beberapa
istilah yang harus diketahui di Sel Elektrolisis:
- Elektrolit : larutan yang bisa menghantarkan arus listrik (sebagai pengisi sel elektrolisis)
Macam - Macam Elektrolit :
1. Elektrolit Larutan, contoh : NiSO4,
CuSO4, NaCl(aq)
Ciri - cirinya adalah berupa larutan ion dan jika ada
tanda fase adalah Aqueous (aq) dan Liquid (l). Untuk elektrolit larutan
ketentuan penguraian di katoda dan anoda mengacu ke persyaratan kondisi
elektroda.
2. Elektrolit Lelehan / Leburan / Endapan,
contoh : NaCl(s), leburan garam dapur dll
Ciri - cirinya adalah tanda fase nya adalah solid (s).
Untuk elektrolit berupa lelehan, penguraian katoda tetap di elektrolit,
namun anoda mengikuti persyaratan kondisi elektroda.
- Elektroda : tempat terjadinya reaksi redoks. Ada 2 elektroda yaitu elektroda negatif (katoda) dan elektroda positif (anoda)
- Kawat Penghantar : penghantar aliran elektron dan arus listrik dari satu elektroda ke elektroda lainnya
Macam - Macam Elektroda :
1. Elektroda Inert (tidak bereaksi
dengan logam), contoh : Pt, Au, C
Penguraian di Anode dan Katode murni dari larutan
saja, elektroda inert tidak terjadi penguraian. Syarat - syarat
yang harus dipenuhi jika menggunakan elektroda inert adalah :
- Untuk Katoda, jika ion berasal dari Gol. 1A (kecuali H+), 2A, Al3+ dan Mn2+ maka yang terurai adalah airnya, sesuai reaksi : 2 H2O + 2e ---> H2 + 2 OH-
- Untuk Anoda, jika elektrolit berasal dari ion kompleks yang mengandung oksigen seperti SO42-, PO43-, CO32-, CrO4-, ClO- dll, maka yang bereaksi adalah airnya sesuai reaksi : 2 H2O ---> 4 H+ + O2 + 4e
2. Elektroda Non Inert : Ni, Cu, Zn, Fe
dll
Elektroda non inert bereksi di Anode
saja, contoh :
Larutan NiSO4 dengan elektroda Cu, maka
proses elektrolisisnya :
NiSO4 ---> Ni2+ + SO42-
Katoda (-) : Ni2+ + 2e ---> Ni
Anoda (+) : Cu ---> Cu2+ + 2e (jadi
Anoda yang seharusnya terurai dari larutan, karena memakai elektroda non inert
maka elektrodanya yang terurai)
- Katoda (Elektroda Negatif) : Sel tempat berlangsungnya proses Reduksi (KaRed = Katoda Reduksi)
- Anoda (Elektroda Positif): Sel tempat berlangsungnya proses Oksidasi (AnOks) = Anoda Oksidasi)
- Reduksi : Proses terurainya ion larutan menjadi bentuk atomnya (mengalami penurunan Bilangan Oksidasi (BilOks) dan menerima elektron)
- Oksidasi : Proses terurainya ion larutan yang mengalami kenaikan Bilangan Oksidasi dan melepas elektron
- Bilangan Oksidasi (BilOks) : Jumlah muatan negatif dan positif dari atom
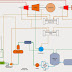
Contoh sel elektrolisis Larutan NaCl menggunakan
elektroda inert Grafit (C) :
Keterangan :
NaCl ---> Na+ + Cl-
Katoda (-) : 2 H2O + 2e ---> H2
+ 2 OH-
Anoda (+) : 2 Cl- ---> Cl2 +
2e
- Elektrolit : larutan NaCl
- Elektroda : dari Grafit (C) yang berarti tidak ada reaksi elektroda di Anoda namun penguraian elektrolit
- Sumber arus DC dari baterai
Arus elektron mengalir dari kutub
negatif (-) ke kutub positif (+) yang berbeda dengan arus baterai (arus
listrik) yang mengalir dari kutub positif (+) ke kutub negatif (-).
- Katoda (-) dihubungkan dengan kutub negatif (-) dari baterai sehingga muatan di katoda menjadi negatif yang mengakibatkan elektron mengalir dari elektroda ke kation (+) dari larutan elektrolit sehingga larutan ion terurai menjadi atomnya disebut Reduksi. Karena potensial reduksi (Ered) air lebih besar dari Na+ maka yang di reduksi adalah airnya
- Anoda (+) dihubungkan dengan kutub positif (+) dari baterai sehingga muatan di anode menjadi positif yang mengakibatkan penarikan anion (-) dari larutan elektrolit disebut Oksidasi. Anion (-) berupa Cl- tertarik ke elektroda karena positif (ingat prinsip aliran elektron) sehingga menghasilkan gas Cl2
Aplikasi Elektrolisis :
- Penyepuhan Sendok dari Besi (Fe) dengan Perak (Ag)
Elektrolit : AgNO3
(harus menggunakan larutan penyepuh yang bersifat logam mulia, yang masih
mengandung logam dari elektrode yaitu perak (Ag))
Katode (-) : logam besi (Fe) ---> karena
penyepuh adalah Ag+ yang mengalami reduksi sesuai reaksi : Ag+
+ e ---> Ag, maka dengan ditempatkan logam Fe di Katode maka diharapkan atom
perak (Ag) hasil reduksi menempel di besi (Fe)
Anode (+) : logam perak (Ag) ---> karena
elektrolit mengandung perak (Ag) dan ini yang dibutuhkan untuk penyepuhan maka
lama kelamaan akan habis dan untuk menambah digunakan anode dari logam perak
(Ag) karena logam akan terkikis sedikit demi sedikit. Elektroda adalah non inert dari perak (Ag) maka di Anoda yang
bereaksi adalah elektrodanya bukan larutan elektrolit, sesuai reaksi : Ag
---> Ag+ + e
Prosesnya : Ag+ dari Anode dengan bantuan 1
elektron akan melarut ke larutan elektrolit dan menempel di Katode dan elektron
dibutuhkan oleh Katode untuk mereduksi Ag+ menjadi Ag dan endapan Ag
melapisi sendok.
- Pemurnian Logam Kotor
- Pembuatan Gas
Referensi :
[1]http://www.cres.gr/kape/publications/papers/dimosieyseis/ydrogenA%20REVIEW%20ON%20/WATER%20ELECTROLYSIS.pdf
[2] http://chemistry.tutorvista.com/inorganic-chemistry/list-of-electrolytes.html
[3]https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook /electrochemistry-/electrochemistry-18/electrolysis-132/electrolysis-of-sodium-chloride 529-3650/
[4] http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch20/faraday.php
[5] http://dokumen.tips/documents/perlindungan-katoda.html
ARTIKEL TERKAIT :
1. Sel Elektrokimia : SEl VOLTA / SEL GALVANI (1 of 2)
2. Istilah Mirip tapi Tidak Sama Artinya di Teknik Kimia (2 of 2)
3. Asset Wellness "Thermography" Rotating Equipment PLTU
[1]http://www.cres.gr/kape/publications/papers/dimosieyseis/ydrogenA%20REVIEW%20ON%20/WATER%20ELECTROLYSIS.pdf
[2] http://chemistry.tutorvista.com/inorganic-chemistry/list-of-electrolytes.html
[3]https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook /electrochemistry-/electrochemistry-18/electrolysis-132/electrolysis-of-sodium-chloride 529-3650/
[4] http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch20/faraday.php
[5] http://dokumen.tips/documents/perlindungan-katoda.html
ARTIKEL TERKAIT :
1. Sel Elektrokimia : SEl VOLTA / SEL GALVANI (1 of 2)
2. Istilah Mirip tapi Tidak Sama Artinya di Teknik Kimia (2 of 2)
3. Asset Wellness "Thermography" Rotating Equipment PLTU